El modelo atómico de Schrödinger, creado en el año 1924, es considerado como un modelo cuántico no relativista, ya que está basado en la solución de la ecuación quer propuso Schrödinger para hallar el potencial electrostático con la simetría esférica, esta solución es conocida como átomo hidrogenoide.
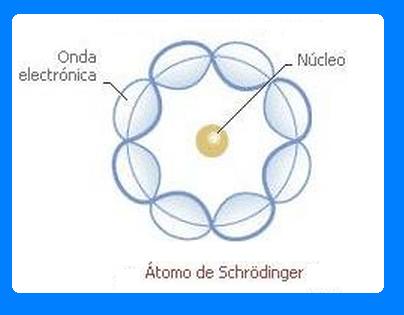
Según este modelo atómico, se dispone que los electrones eran contemplados en forma de una onda estacionaria, además que la amplitud de la materia decaía velozmente al superar el radio atómico.
En el modelo atómico que propone Schrödinger se postula que los electrones son como ondas de materia, entonces la ecuación de este describe la evolución en el tiempo y en el espacio de esta onda material.
Cabe recalcar que el modelo atómico de Schrödinger llega a predecir de manera adecuada las líneas de emisión espectrales, tanto de los átomos neutros como de los átomos ionizados.
Además este modelo atómico llega a determinar la modificación de los diferentes niveles de energia, siempre y cuando exista un campo magnético o un campo eléctrico. También, realizando algunos cambios semiheurísticos este modelo llega a determinar el enlace químico y la estabilidad que tendrán las moléculas. El modelo postula que cuando se requiere una alta precisión en los niveles energéticos es posible emplear un modelo parecido al de Schrödinger, solo si el electrón está descrito através de la ecuación relativista de Dirac, en la cual se dice que el átomo se encuentra en su propio eje.
En resumen el modelo de Schrödinger llega a describir de forma adecuada la estructura electrónica que tienen los átomos, pero tiene algunas carencias y fallas como las que se explican a continuación:
- Primero el modelo de Schrödinger en lo que respecta a la formulación original no posee el espín de los electrones, este error luego sería arreglado en el modelo que postularian Schrödinger-Pauli.
- Luego el modelo de Schrödinger desconoce los efectos relativistas que tienen los electrones veloces, también este error es reparado en la ecuación que crea Dirac, en la cual incluye una descripción del espín electrónico.
- Otra falla del modelo de Schrödinger, es que no puede explicar el motivo de porqué un electrón que se encuentra en estado cuántico excitado baja a un nivel inferior siempre y cuando este existiera.
|
|
|
|
|
|
|
Modelos anteriores |
 |
|
|
| |
|
|
| |
| |
|
|
| |
|
|